Modèle de la réaction chimique oscillante de Belousov Zhabotinski.
Belousov découvrit en 1958 que l’oxydation de l’acide citrique par le bromate de potassium catalysé par des ions céreux-cériques pouvait donner lieu à une réaction chimique oscillante et Zhabotinski poursuivit cette étude [1]. La réaction de Belousov Zhabotinski s’étudie d’habitude à 25 °C et consiste en un mélange comportant du bromate de potassium, de l’acide malonique ou bromomalonique et du sulfate cérique dissous dans l’acide sulfurique. Elle peut donner lieu à une grande variété de phénomènes allant des oscillations d’une période de quelques dizaines de secondes à l’apparition de phénomènes ondulatoires. Modélisation de la réaction.
Le modèle
Notations
Nous proposons un modèle permettant de simuler l’évolution des concentrations des trois substances principales, concentrations que nous désignerons de la manière suivante :
Écrivons encore :
Schéma réactionnel
Le mécanisme de Noyes [2] peut alors s’exprimer par les étapes suivantes :
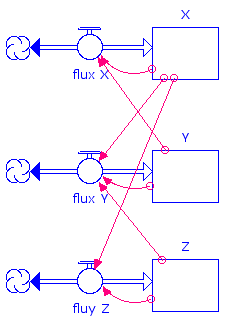
Ce schéma réactionnel, appelé « Oregonateur », comporte un mécanisme de catalyse croisée : Y produit X, X produit Z qui en retour produit Y.
Équations différentielles correspondant au schéma réactionnel
En examinant où chaque substance apparaît ou disparaît dans le schéma réactionnel, en admettant une variation proportionnelle aux concentrations en présence et en posant A=B, on établit les équations différentielles :
Diagramme Stella traduisant les équations différentielles
Les équations différentielles se traduisent aisément en un diagramme Stella qui met ici en évidence le mécanisme de catalyse croisée :
Constantes cinétiques et paramètre d’ajustement
Pour simuler une réaction oscillante, nous introduisons les constantes cinétiques $k_i$ et un paramètre d’ajustement f dans les équations [3] :
En résolvant ces équations et en reportant les concentrations X, Y et Z en fonction du temps, on fait alors clairement apparaître des oscillations :
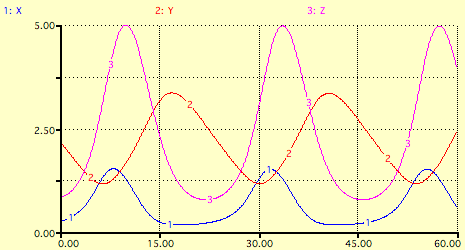
Concentrations initiales, constantes cinétiques et paramètre f
Utiliser un simulateur de la réaction
Conclusion
Ce type de réaction illustre le fait que le comportement thermodynamique d’un système peut être très différent loin de l’équilibre et à l’opposé de celui prévu par le théorème de production minimale d’entropie établi par Prigogine [4]. Le non-équilibre peut être une source d’ordre.
Voir aussi (from Wolfram Demonstrations Project)
– Complex Dynamics in Chemical Self-Replication
– Idealized Belousov Zhabotinsky Reaction
